 |
UNIVERSITÀ DEGLI STUDI DI ROMA La Sapienza Domanda di finanziamento ricerca di Ateneo |
 |
UNIVERSITÀ DEGLI STUDI DI ROMA La Sapienza Domanda di finanziamento ricerca di Ateneo |
|
PIANCATELLI (cognome) |
Giovanni (nome) |
|
Prof. Ordinario (qualifica) |
21/10/1937 (data di nascita) |
|
SCIENZE MATEMATICHE FISICHE e NATURALI (facoltà) |
CHIMICA (dip/istit) |
|
Piazz.le Aldo Moro, 5 00185 ROMA (indirizzo) |
|
|
06/49913861 (telefono) |
06/490631 (fax) |
|
Giovanni.Piancatelli@uniroma1.it (e-mail) |
|
| 1. | GLICALI, FOSFONATI |
| 2. | C-GLICOSIDI |
| 3. | LATTAMI, LATTONI |
| 4. | AMMINAZIONE |
| 5. | CICLIZZAZIONI |
| 2.2 Ambito della ricerca | 2.3 Tipologia |
|---|---|
|
Istituto/Dipartimento |
Nuova ricerca |
| nº | Cognome | Nome | Qualifica | Facoltà | Ist./Dip. |
|---|---|---|---|---|---|
| 1. | D'ANNIBALE | Andrea | RU | SCIENZE MATEMATICHE FISICHE e NATURALI | DIP. CHIMICA |
| 2. | LORETO | Maria Antonietta | PA | SCIENZE MATEMATICHE FISICHE e NATURALI | DIP. CHIMICA |
| 3. | PASSACANTILLI | Pietro | RU | SCIENZE MATEMATICHE FISICHE e NATURALI | DIP. CHIMICA |
In questo spazio non inserire personale docente e tecnici laureati dell'Ateneo
2001 Voce A 0 Voce B 20658 Voce C 0
2002 Voce A 0 Voce B 20000 Voce C 18600
2003 Voce A 0 Voce B 20000 Voce C 18600
Contestualmente alla domanda di Ateneo, il proponente sta presentando anche domanda di Facoltà?
Firma Data 28/04/2005 16:25
nº
Cognome
Nome
Qualifica
Facoltà
Ist./Dip.
Note
1.
LEONELLI
FRANCESCA
Contrattista di ric.
SCIENZE MAT.FIS.NAT.
Dip.CHIMICA
01/01-31/12/2005
2.
MIGLIORINI
ANTONELLA
Dottorando
SCIENZE MAT.FIS.NAT.
Dip.CHIMICA
Ciclo XIX
3.
CAPUZZI
MARINELLA
Dottorando
SCIENZE MAT.FIS.NAT.
Dip.CHIMICA
Ciclo XX
Personale di altre Università/Istituzioni
nº
Cognome
Nome
Qualifica
Universita'/Istituzione
Ist./Dip.
Note
2.5 Inquadramento della ricerca proposta (in ambito nazionale ed internazionale)
Si propone un programma di ricerca, definito da precisi obiettivi ed organizzato lungo le seguenti linee:
Linea 1: Glicali derivati da comuni carboidrati come intermedi economici e da fonti rinnovabili per sintesi di prodotti biologicamente attivi.
Negli ultimi anni, la chimica dei carboidrati ha suscitato un crescente interesse nella ricerca scientifica, grazie al ruolo fondamentale degli zuccheri in molti processi vitali. I carboidrati, infatti, sono indispensabili per i processi di conservazione di energia e agiscono da elementi di comunicazione intercellulare e riconoscimento intracellulare (1). Inoltre, il loro basso costo, la loro abbondanza e la facilità con cui possono essere ottenuti in maniera ecocompatibile da fonti rinnovabili sono caratteristiche che li rendono ottimi substrati di partenza in sintesi organica. Per questo, essi sono stati e continuano ad essere uno degli elementi unificanti tra la chimica organica, la chimica medicinale e la biologia. La preparazione di nuovi derivati sintetici degli zuccheri, potenzialmente in grado di modificare l’attività degli enzimi che processano i carboidrati naturali, è un campo di ricerca in crescente espansione, grazie alle applicazioni che potrebbero derivarne in medicina. In quest’ambito, di rilevante importanza è la sintesi di nuovi C-glicosidi, analoghi degli O-glicosidi, in cui il legame glicosidico C-O è sostituito da un legame C-C. Poiché tale modifica comporta una maggiore stabilità di questi composti rispetto ai corrispondenti O-glicosidi, sia verso l’azione di acidi che di enzimi, i C-glicosidi sono frequentemente utilizzati come efficaci glicomimetici (2). Inoltre, il frammento C-glicosidico è presente in numerose sostanze naturali dalle importanti proprietà farmacologiche (2).
Infine tra i numerosi derivati dei carboidrati, i glicali stanno avendo nella chimica organica di sintesi numerose interessanti applicazioni (3]. In aggiunta al loro ben noto ruolo nel trovare nuovi prodotti biologicamente attivi, i glicali danno luogo ad una varietà di nuove reazioni, dovute alla loro struttura chimica facilmente manipolabile. Da citare ad esempio l’applicazione con successo nella sintesi di oligosaccaridi da glicali legati a polimeri.
1. Rademacher, T. W.; Parekh, R. B.; Dwek, R. A. Annu. Rev. Biochem. 1988, 57,785.
2. (a) Levy, D. E.; Tang, C. The chemistry of C-Glycosides, Pergamon 1995 vol. 13; (b) Postema , M. H. D. C-Glycoside Synthesis, CRC Press: London, UK, 1995.
3. a) S. J. Danishefsky, M. T. Bilodeau, Angew. Chem. 1996, 108, 1482-1522; Angew. Chem. Int. Ed. 1996, 35, 1380-1419; b)D. Obrecht, J. M. Villalgordo, Solid-Supported Combinatorial and Parallel Synthesis of Small-Molecular-Weight Compound Libraries, Elsevier Science Ltd., Oxford, 1998.
Linea 2: Sviluppo di nuove metodologie per sintesi di lattami e lattoni biologicamente attivi.
La sintesi di ammino derivati rappresenta un ruolo chiave nella ricerca essendo la funzione amminica presente in molte classi di composti di interesse farmaceutico e biologico come ammino acidi, ammino alcoli, allilammine, e ammino zuccheri. Nel quadro molto ampio delle sintesi proposte per ottenere questi prodotti, in modo regioselettivo e stereoselettivo, alcune si avvalgono dell'utilizzo di agenti amminanti. Reagenti studiati a questo scopo, con buoni risultati, sono i nitreni e alcuni carbammati. In questo ambito si inquadra la ricerca con l'obiettivo di studiare nuove vie di sintesi di composti in cui sia presente una funzione amminica e che possano essere obiettivi sintetici di notevole interesse. Il programma si basa sulla precedente esperienza dell’unità nelle reazioni di amminazione di alcheni sia elettronricchi che elettronpoveri tramite il nosilossicarbammato di etile (NsONHCO2Et) per ottenere ammino derivati.
Tale linea di ricerca riguardera' la sintesi di composti lattonici ad attivita' odorifera attraverso reazioni di ciclizzazione mediata da opportuni catalizzatori. La preparazione dei profumi e degli aromi costituisce un settore di applicazione estremamente importannte della chimica organica. In questo senso, estrema attenzione viene data nell’ultima decennio alla sintesi di molecole odorose attraverso processi basati su catalisi omogenea ed eterogenea ed in particolare catalisi metallica ed enzimatica.
I motivi di cio’ sono che la catalisi permette di abbassare significativamente i costi di produzione del prodotto, permettendo di ottenere vie sintetiche piu’ brevi e piu’ efficienti. Inoltre i processi catalitici hanno indiscutibili vantaggi di tipo ambientale rispetto a processi che impieghino quantita’ stechiometriche di reagenti, e la maggiore selettivita’ dei processi catalitici migliora il rapporto tra la quantita’ di prodotto desiderato e i prodotti di scarto, che comunque devoono essere trattati.
In questo quadro si colloca la reazione di metatesi olefinica catalizzata da complessi metallici, che e’ uno strumento potente di formazione di legami C-C e che si cerchera’ di aspplicare alla sintesi di compostii odorosi importanti dal punto di vista cosmeticoo ed alimentare.
2.6 Sintesi del programma di ricerca e descrizione dei compiti dei singoli partecipanti
In questa linea di ricerca, di rilevante importanza è la sintesi di nuovi C-glicosidi, analoghi degli O-glicosidi, in cui il legame glicosidico C-O è sostituito da un legame C-C. Poiché tale modifica comporta una maggiore stabilità di questi composti rispetto ai corrispondenti O-glicosidi, sia verso l’azione di acidi che di enzimi, i C-glicosidi sono frequentemente utilizzati come efficaci glicomimetici (1). Inoltre, il frammento C-glicosidico è presente in numerose sostanze naturali dalle importanti proprietà farmacologiche (1).
Il nostro gruppo di ricerca si è recentemente interessato alla sintesi stereoselettiva di 3-osso-2-fosfono-a-C-glicosidi di tipo 1, diretti precursori di 2-fosfono-a-C-glicosidi (2). Per la formazione del legame C-glicosididico, è stata messa a punto una strategia basata su reazioni di addizione di Michael di organo-cuprati su enoni derivati dei glicali di tipo 2 (Schema 1). La presenza del gruppo dietossifosfonato, oltre ad avere avuto un ruolo chiave nella cinetica della reazione, potrebbe attribuire ai composti ottenuti interessanti proprietà biologiche (3).
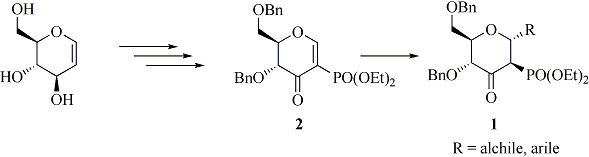
Seguendo questa linea di ricerca ci proponiamo di estendere la reazione di addizione di Michael ad opportuni nucleofili per l’ottenimento di interessanti composti quali ad esempio di- e trisaccaridi, N-,S-,O-glicosidi contenenti il gruppo dietossifosfonato.
Successivamente sarebbe interessante studiare la possibilità di preparare, a partire dai composti di tipo 2, zuccheri C-branched di tipo 3, molecole altamente funzionalizzate, utili per ulteriori trasformazioni (4). Tali composti potrebbero essere preparati per addizione di Michael con nucleofili all’ossigeno e successiva reazione di Wittig-Horner (Schema 2).
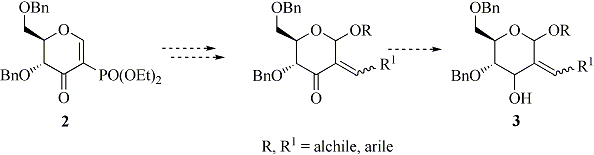
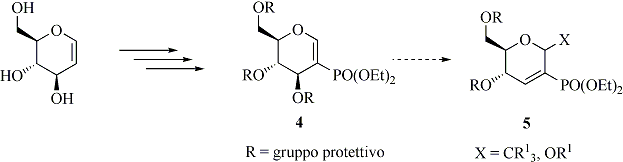
Un altro obiettivo che ci proponiamo di affrontare è la sintesi dei C,O-pseudoglicali, ossia glicali 2,3-insaturi, utili building blocks chirali per la sintesi di glicoconiugati e antibiotici polieterei (5). Considerando la ben nota reattività dei glicali nella trasposizione allilica acido catalizzata [riarrangiamento di Ferrier (6)], vogliamo studiare tale reazione sui nuovi composti di tipo 4, ottenuti a partire dai glicali (Schema 3). Si considererà la possibilità di effettuare tale reazione con catalizzatori acidi inorganici a basso impatto ambientale e in condizioni blande. I composti di tipo 5 costituirebbero dei versatili intermedi grazie alla presenza del doppio legame, attivato dal gruppo dietossifosfonato, ulteriormente funzionalizzabile.
------------------------------------------------------------------
1. (a) Levy, D. E.; Tang, C. The chemistry of C-Glycosides, Pergamon 1995 vol. 13; (b) Postema , M. H. D. C-Glycoside Synthesis, CRC Press: London, UK, 1995.
2. Leonelli, F.; Capuzzi, M.; Calcagno, V.; Passacantilli, P.; Piancatelli, G. Eur. J. Org. Chem. 2005, in corso di stampa.
3. (a) Pachamuthu, K.; Figueroa-Perez, I.; Ali, I. A. I.; Schmidt, R. Eur. J. Org. Chem. 2004, 3959-3961 e riferimenti ivi citati; (b) Engel, R. Chem. Rev. 1977, 77, 349-367 e riferimenti ivi citati; (c) Junker, H. D.; Fessner, W. D. Tetrahedron Lett. 1998, 39, 269-272 e riferimenti ivi citati; (d) Dondoni, A.; Marra, A.; Pasti, C. Tetrahedron Asymmetry 2000, 11, 305-317 e riferimenti ivi citati; (e) Orsini, F.; Caselli, A. Tetrahedron Lett. 2002, 43, 7259-7261 e riferimenti ivi citati.
4. Chapleur, Y.; Chrétien, F. In Preparative Carbohydrate Chemistry; Hanessian, S., Ed.; Marcel Dekker: New York, 1997; pp 207-262.
5. (a) Danishefsky, S. J; Allen, J. R. Angew. Chem. Int. Ed. 2000, 39, 836-863; (b) Nicolaou, K. C.; Mitchel, H. J. Angew. Chem. Int. Ed. 2001, 40, 1576-1624.
6. (a) Misra, A. K.; Tiwari, P. Agnihotri, G. Synthesis 2005, 2, 260; (b) Smitha, G.; Reddy, Ch. Sanjeeva Synthesis 2004, 6, 834; (c) Masson, C.; Soto, J.; Bessodes, M. Synlett 2000, 9, 1281.
Lnea 2 Sviluppo di nuove metodologie per sintesi di lattami e lattoni biologicamente attivi (Loreto, D'Annibale, Migliorini, e sei laureandi)
In precedenti ricerche era stato verificato che il nosilossicarbammato di etile in presenza di trietilammina reagisce con sililcheteneacetali (1) per dare in buone rese N-(etossicarbonil)ammino esteri; con olefine attivate come gli allilsilani (2)erano stati ottenuti N-(etossicarbonil)allilammine.
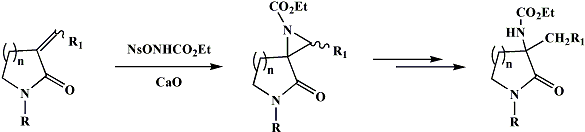
Lo stesso reattivo, in presenza di CaO è stato utilizzato per l'amminazione di olefine elettron povere con una procedura che richiede piccole quantità di solvente e una base inorganica insolubile, non sono necessari solventi anidri né alte temperature, condizioni (che possono essere considerate) ecocompatibili. Mediante questa procedura, è stato possibile trasformare esteri carbossilici o fosfonici alfa-beta insaturi in aziridin carbossilati (3) e fosfonati (4), precursori di ammino acidi.
Nell’ambito dell’ interesse nell’area delle aziridinazioni di esteri alfa-beta-insaturi (5) recentemente sono stati ottenuti N-(etossicarbonil)spiroaziridino-gamma-lattoni a partire da semplici alfa-iliden gamma-lattoni usando come reattivo il nosilossicarbammato di etile in presenza di CaO (6). L’apertura della aziridina ottenuta ha portato alla formazione di derivati di alfa-ammino lattoni. Questi composti, precursori di alfa-ammino acidi non proteinogeni, analoghi strutturali dell’omoserina, rivestono attualmente un ruolo chiave nella ricerca biochimica in quanto versatili intermedi per la sintesi di agenti immunosoppressori, antiallergici e antineoplastici (7) e building blocks nella sintesi di polipirrolinoni (8). Il crescente interesse sintetico di alfa-ammino gamma lattoni otticamente attivi, ha indotto a proseguire lo studio della stereoselettività del processo di aziridinazione su alfa-iliden gamma-lattoni aventi uno o più sostituenti sull’anello ottenendo interessanti risultati (9).
Attualmente l’interesse è rivolto alla reazione di aziridinazione di lattami a-alchilidenici per ottenere con un processo ecocompatibile derivati di a-ammino lattami, composti studiati quali componenti chiave di molte strutture peptidomimetiche e quali precursori di potenti inibitori enzimatici conformazionalmente bloccati (Schema 1).
Una logica estensione della ricerca in questo stesso ambito riguarda la sintesi e la funzionalizzazione stereoselettiva di lattami a-alchilidenici in cui sia presente un centro stereogenico o sull’anello o sul sostituente dell’azoto lattamico.
L'ottenimento di composti di importanza biologica spinge ad estendere lo studio della reazione di amminazione anche a glicali nell’ ipotesi di ottenere derivati di ammino zuccheri con metodiche semplici che permettano l’uso di tecnologie a basso impatto ambientale.
Sulla base della esperienza maturata sulla reattività di allilsilani variamente funzionalizzati (10) la reazione di amminazione con il nosilossicarbammato di etile è stata di recente applicata con successo ad alfa-iliden gamma-lattoni sililati e ad allilsilani aventi una funzione chetonica in beta rispetto al silicio. La presenza del (trimetilsilanil)metile sul doppio legame, facilita ed indirizza l’apertura dell’aziridina intermedia consentendo di ottenere derivati di alfa-ammino lattoni insaturi e di beta-ammino chetoni alfa,beta-insaturi, questi ultimi composti presentano attività sia analgesica che antibatterica (SCHEMA 2).
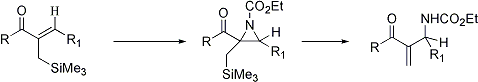
E’ in progetto la sintesi di substrati analoghi otticamente attivi con lo scopo di ottenere un’amminazione stereoselettiva (Schema 3).
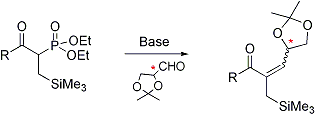
Per quanto riguarda la sintesi di lattoni bioattivi, di recente sono stati preparati con la metatesi olefinica butenolidi aventi adatte funzionalita’, come quelli a struttura 1, utili come diretti precursori dei composti a struttura 4-idrossimetil-5-alchil-2(5H)furanonica 2, importanti composti antibiotici estratti da fonti marine.
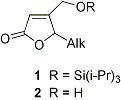
Questa linea di ricerca verra’ continuata nel presente progetto, cercando di migliorare la stereoselettivita’ globale nell’ottenimento dei lattoni saturi 4-metil-5-alchilsostituiti.
Questo sara’ fatto cercando di sintetizzare i metallilacrilati 4 in forma enantiomericamente pura attraverso un approccio che prevede l’ottenimento stereoselettivo dei loro alcooli precursori 3 attraverso addizione di composti alchilzinco alla metacroleina in presenza di leganti chirali, e loro successiva acilazione.
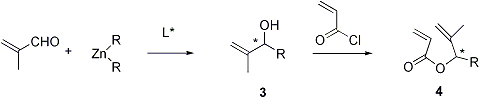
L’altro stadio fondamentale nella preparazione stereoselettiva dei lattoni a struttura 6 e’ la riduzione del doppio legame C=C butenolidico. Dal momento l’ingombro sterico del gruppo R nei butenolidi 5 non e’ stato sufficiente per una completa diastereoselezione verso i lattoni saturi cis nei metodi tradizionali di idrogenazione per catalisi eterogenea, questo ci portera’ a provare la stessa riduzione in presenza di un enzima come lievito di birra, descritto in letteratura come un efficace riducente di butenolidi non sostituiti dal gruppo metilico sul doppio legame.
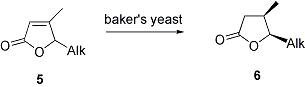
Questa ricerca verra’ ampliata applicando la reazione di Grubbs alla di sintesi di altri composti lattonici odorosi interessanti dal punto di vista alimentare.
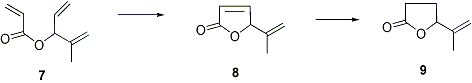
La sequenza sintetica gia’ illustratata verra’ applicata alla sintesi del lattone 9, presente nell’estratto del luppolo. Oltre all’interesse della molecola proposta come obiettivo, la presenza nella porzione alcossilica dell’acrilato precursore 7 di due olefine a differente grado di sostituzione ci consentira’ di studiare anche la chemoselettivita’ della reazione di Grubbs tra questi due diversi tipi di alcheni.
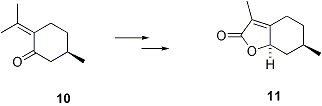
Verra’ inoltre provato un ulteriore approccio sintetico alla inportante classe dei mentanlattoni ed isomentanlattoni. In particolare, l’obiettivo principale di questo appproccio e’ costituito dal lattone della menta 11, presente nell’aroma di menta piperita, che trova notevole uso in profumeria, e nella preparazione e aromatizzazione di alimenti.
La sintesi di 11 verra’ condottta a partire dal pulegone 10, disponibile commercialmente in entrambe le forme otticamente attive.
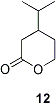
Come ulteriore obiettivo, ci proponiamo la sintesi attraverso la metatesi di Grubbs del lattone a sei termini 12, molto importante come composto aromatizzante del tabacco.
1. Loreto, M. A; Tardella, P. A.; Tedeschi, L.; Tofani, D. Tetrahedron Lett., 1997, 38, 5717.
2. Loreto, M. A; Tardella, P. A.; Tofani, D. Tetrahedron Lett., 1995, 36, 8295.
3. Carducci, M.; Fioravanti, S.; Loreto, M.A.; Pellacani, L.; Tardella, P.A. Tetrahedron Lett., 1996, 37, 3777.
4. Loreto, M.A.; Pompili, C.; Tardella, P.A. Tetrahedron, 2001, 57, 4423.
5. Gasperi, T.; Loreto, M. A.; Tardella, P. A. Tetrahedron Lett., 2003, 44, 8467.
6. Gasperi, T.; Loreto, M. A.; Tardella, P. A.; Veri, E. Tetrahedron Lett., 2003, 44, 4953.
7. Graham, S. L.; deSolms, S. J.; Giuliani, E. A.; Kohl, N. E.; Mosser, S. D.; Oliff, A. I.; Pompliano, D. L.; Rands, E.; Breslin, M. J.; Deana, A. A.; Garsky, V. M.; Scholz, T. H.; Gibbs, J. B.; Smith, R. L. J. Med. Chem., 1994, 37, 725.
8. Smith III, A.B.; Liu, H.; Hirschmann, R. Org. Lett., 2000, 2, 2037.
9. Gasperi, T.; Loreto, M. A.; Migliorini, A.; Tardella, P. A. Heterocycles, 2005, 65 (6), 0000.
10. Loreto, M.A.; Pompei, F.; Tardella, P.A.; Tofani, D. Tetrahedron, 1997, 53, 15853;
3. Elenco delle migliori pubblicazioni negli ultimi 5 anni
A) Pubblicazioni su riviste scientifiche
1.
PIANCATELLI G.; LEONELLI F.; CALCAGNO V.; CAPUZZI M.; PASSACANTILLI P. (2005). Stereoselective Michael-Type Addition of Organocopper Reagents to Enones Derived from Glycals in the Synthesis of 2-Phosphono-a-C-Glycosides
EUROPEAN JOURNAL OF ORGANIC CHEMISTRY ISSN: 1434-193X In press
2.
BELLA M.; CIANFLONE M.; MONTEMURRO G.; PASSACANTILLI P.; PIANCATELLI G. (2004). Chemistry of Odorants: Stereoselective Synthesis of Octahydronaphthalene-based perfumery Georgywood, (+,-)-1- [(1R*, 2S*)-1,2,3,4,5,6,7,8-Octahydro- 1,2,8,8-tetramethylnaphthalen-2-yl]ethan-1-one
TETRAHEDRON vol. 60 pp. 4821-4827 ISSN: 0040-4020
3.
PASSACANTILLI G.; PIANCATELLI G.; PEPE S.; PIGINI D.; SQUARCIA A. (2004). Oxime-based methods for synthesis of stereodefined acyclic polyfunctionalized d-azidonitriles and 5-substituted isoxazoles from carbohydrate derivatives.
TETRAHEDRON vol. 60 pp. 6453-6459 ISSN: 0040-4020
4.
PASSACANTILLI P.; CENTORE C.; CILIBERTI E.; PIANCATELLI G.; LEONELLI F. (2004). Neighboring-Group Participation in Nitrile-Forming Beckmann Fragmentation Reactions: Synthesis of Enantiopure (E)-2,3-Di-O-substituted-5-methoxy- pent-4-enenitriles and Their Conversion into Pyranosylamines
EUROPEAN JOURNAL OF ORGANIC CHEMISTRY vol. = pp. 5083-5091 ISSN: 1434-193X
5.
SQUARCIA A.; MARRONI S.; PIANCATELLI G.; PASSACANTILLI P. (2004). Glycal-mediated Syntheses of Enantiomerically Pure 3-Azido-2,3-Dideoxy-Hexopyranosides and 3-Amino-2,3-Dideoxy-Hexopyranolactones.
TETRAHEDRON-ASYMMETRY vol. 15 pp. 3769-3773 ISSN: 0957-4166
6.
PIANCATELLI G.; PIGRO M.C.; ANGIUONI G. (2002). Readily available carbohydrate-derived imines and amides as chiral ligands for asymmetric catalysis.
TETRAHEDRON vol. 58 pp. 5459-5466 ISSN: 0040-4020
7.
PIANCATELLI G.; SQUARCIA A.; VIVOLO F.; WEINIG H.G.; PASSACANTILLI P. (2002). Glycal-mediated Synthesis of Enantiomerically Pure Polyhydroxylated g- and d-Lactams.
TETRAHEDRON LETTERS vol. 43 pp. 4653-4655 ISSN: 0040-4039
8.
PIANCATELLI G.; WEINIG H.G.; COLAPIETRO G.; PASSACANTILLI P. (2002). Glycal-mediated synthesis of enantiomerically pure 5-substituted isoxazoles containing a differentially O-benzylated glycerol moiety.
TETRAHEDRON LETTERS vol. 43 pp. 4613-4615 ISSN: 0040-4039
9.
PIANCATELLI G.; BELLA M.; SQUARCIA A. (2001). Efficient preparation of 3-substituted furan-2(5H)-ones and their direct vinylogous aldol addition.
TETRAHEDRON vol. 57 pp. 4429-4436 ISSN: 0040-4020
10.
PIANCATELLI G.; GRAZIANI A.; PASSACANTILLI P.; TANI S. (2001). A mild and efficient approach for the regioselective silyl-mediated
protection-deprotection of C-4 hydroxyl group on carbohydrates
TETRAHEDRON LETTERS vol. 42 pp. 3857-3860 ISSN: 0040-4039
11.
PIANCATELLI G.; BELLA M.; MARGARITA R.; ORLANDO C.; ORSINI M. PARLANTI L. (2000). Asymmetric carbolithiation of 2-phenylselenofumarate derivatives: a short synthesis of (-)-roccellaric acid.
TETRAHEDRON LETTERS vol. 41 pp. 561-565 ISSN: 0040-4039
12.
PIANCATELLI G.; BELLA M.; SQUARCIA A.; TROLLI C. (2000). Direct vinylogous aldol addition of gamma-butyrolactones and gamma-butyrolactams
TETRAHEDRON LETTERS vol. 41 pp. 3669-3672 ISSN: 0040-4039
13.
PIANCATELLI G.; GRAZIANI A.; PASSACANTILLI P.; TANI S. (2000). 2-Deoxy-disaccharide approach to natural and unnatural glycosphingolipids synthesis
TETRAHEDRON-ASYMMETRY vol. 19 pp. 3921-3937 ISSN: 0957-4166
14.
PIANCATELLI G.; MARGARITA R.; MERCANTI C.; PARLANTI L. (2000). Hypervalent iodine-induced multi-component reactions: novel thiocyano- and isothiocyano-phenylselenenylating reaction of alkenes
EUROPEAN JOURNAL OF ORGANIC CHEMISTRY vol. = pp. 1865-1870 ISSN: 1434-193X
15.
GASPERI T., LORETO M. ANTONIETTA, MIGLIORINI A., TARDELLA P. A. (2005). Spiroaziridines from 4-substituted- alpha- ylidene-gamma-butyrolactones”. HETEROCYCLES. vol. 65 ISSN: 0385-5414. accettato 8 Aprile 2005.
16.
DOSZCZAK L., GASPERI T., SAINT-DIZIER A., LORETO M. ANTONIETTA, ENDERS D. (2004). Silylating reagents: A powerful tool for the construction of isosteric analogs of highly branched odorants. CHEMISTRY & BIODIVERSITY. vol. 1, pp. 1921-1935 ISSN: 1612-1872.
17.
GASPERI T., LORETO M. ANTONIETTA, TARDELLA P. A. (2003). SYNTHESIS OF BETA-BETA-BRANCHED BETA-AMINO ESTER DERIVATIVES THROUGH SPIROAZIRIDINATION OF (ALFA-TRIMETHYLSILANYLMETHYL)CYCLOHEXYLIDENE ESTERS. TETRAHEDRON LETTERS. vol. 44, pp. 8467 ISSN: 0040-4039.
18.
GASPERI T., LORETO M. ANTONIETTA, TARDELLA P. A., VERI E. (2003). SYNTHESIS OF ALPHA-AMINO GAMMA-BUTYROLACTONE DERIVATIVES BY AZIRIDINATION OF ALPHA-YLIDENE GAMMA-BUTYROLACTONES. TETRAHEDRON LETTERS. vol. 44, pp. 4953 ISSN: 0040-4039.
19.
FRANCAVILLA M., GASPERI T., LORETO M. ANTONIETTA, TARDELLA P. A., BASSETTI M. (2002). OZONIZATION AND REDUCTION OF ALPHA-METHYLENE N-(ETHOXYCARBONYL)-BETA-AMINO PHOSPHONIC ESTERS. TETRAHEDRON LETTERS. vol. 43, pp. 7913 ISSN: 0040-4039.
20.
GASPERI T., LORETO M. ANTONIETTA, TARDELLA P. A., GAMBACORTA A. (2002). AMINATION OF ALPHA,BETA-UNSATURATED (2-TRIMETHYLSILANYLMETHYL) CARBOXYLIC ESTERS. TETRAHEDRON LETTERS. vol. 43, pp. 3017 ISSN: 0040-4039.
21.
FAZIO A., LORETO M. ANTONIETTA, TARDELLA P.A. (2001). AZIRIDINATION OF ALPHA,BETA-UNSATURATED PHOSPHONIC ESTERS. TETRAHEDRON LETTERS. vol. 42, pp. 2185 ISSN: 0040-4039.
22.
LORETO M. ANTONIETTA, POMPILI C., TARDELLA P.A. (2001). ALPHA-METHYLENE BETA-AMINO PHOSPHONIC ESTERS DERIVATIVES BY AMINATION OF (1-TRIMETYLSILANYILMETHYL-VINYL)PHOSPHONIC ESTERS. TETRAHEDRON. vol. 57, pp. 4423 ISSN: 0040-4020.
23.
FAZIO A., LORETO M. ANTONIETTA, TARDELLA P.A., TOFANI D. (2000). AZIRIDINATION OF CHIRAL 3-(2,2-DIMETHYL-1,3-DIOXOLAN-4YL)-PROPENOATE ESTERS. TETRAHEDRON. vol. 56, pp. 4515 ISSN: 0040-4020.
24.
BASSETTI M., D'ANNIBALE A., FANFONI A., MINISSI F. (in stampa). Synthesis of a,b-unsaturated g-lactones via ring-closing metathesis catalyzed by first generation Grubbs' catalyst. ORGANIC LETTERS. vol. 7 ISSN: 1523-7060. In stampa.
25.
FAVERO G., CAMPANELLA L., CAVALLO S., D'ANNIBALE A., PERRELLA M., MATTEI E., FERRI T. (in stampa). Glutamate Receptor incorporated in a Mixed Hybrid Bilayer Lipid Membranes array, as a Sensing Element of a Biosensor working under flowing conditions. JOURNAL OF THE AMERICAN CHEMICAL SOCIETY. ISSN: 0002-7863. In stampa.
26.
FAVERO G., CAMPANELLA LUIGI, D'ANNIBALE A., FERRI TOMMASO. (2004). Preparation and characterization of a chemically modified electrode based on ferrocene-tethered β-cyclodextrin self assembled monolayers. MICROCHEMICAL JOURNAL. vol. 76, pp. 77-84 ISSN: 0026-265X.
27.
D'ANNIBALE A., FAVERO G., CAMPANELLA L., SANTUCCI R., FERRI T. (2003). MIXED HYBRID BILAYER LIPID MEMBRANE INCORPORATING VALINOMYCIN: IMPROVEMENTS IN PREPARATION AND FUNCTIONING. MICROCHEMICAL JOURNAL. vol. 74, pp. 141-148 ISSN: 0026-265X.
28.
D'ANNIBALE A., FAVERO GABRIELE, CAMPANELLA LUIGI, SANTUCCI R., FERRI TOMMASO. (2002). MEMBRANE SUPPORTED BILAYER LIPID MEMBRANES ARRAY: PREPARATION, STABILITY, AND ION CHANNEL INSERTION. ANALYTICA CHIMICA ACTA. vol. 460, pp. 23-34 ISSN: 0003-2670.
29.
D'ANNIBALE A., TROGOLO CORRADO. (2002). MANGANESE(III)-ROMOTED 4-EXO-TRIG CYCLIZATION OF ENAMIDES TO AZETIDINONES. TRENDS IN HETEROCYCLIC CHEMISTRY. vol. 8, pp. 95-103 ISSN: 0972-432X.
30.
D'ANNIBALE A., CERRETI ALESSANDRA, TROGOLO CORRADO, UMANI FLORIANA. (2000). A Novel Synthesis of tricyclic-fused hydrindene-azetidinone compounds by sequential Mn(III)-promoted 4-exo-trig Cyclization/radical aromatic substitution. TETRAHEDRON LETTERS. vol. 41, pp. 3261-3264 ISSN: 0040-4039.
31.
D'ANNIBALE A., NANNI DANIELE, TROGOLO CORRADO, UMANI FLORIANA. (2000). Diastereoselectivity in Mn(III)-promoted 4-exo-trig Cyclization of Enamides to b-Lactams. ORGANIC LETTERS. vol. 2, pp. 401-402 ISSN: 1523-7060.
B) Pubblicazioni di volumi o saggi in volume
1.
PIANCATELLI G.; LEONELLI F. (2005). Synthesis of (Z)-3,7-dimethyl-2,6-octadien-1-al
In ZERCHER K. C. Organic Synthesis In press
C) Pubblicazioni su atti di convegni e congressi
1.
LORETO M. ANTONIETTA, MIGLIORINI A., TARDELLA P.A. (2005). A new approach to α-methylene- α,β-unsaturated ketones derivatives. First Austrian-German-Italian Meeting of Organic Chemistry (Vienna, Austria,). 1-2 Aprile 2005. (Comunicazione Poster).
2.
CAPUZZI M., GASPERI T., LORETO M. ANTONIETTA, TARDELLA P.A. (2004). Reazione di Cross-Coupling Pd catalizzata per la sintesi di alfa-[(trimetilsililmetil)iliden]-gamma-butirrolattoni. XXIX Convegno Nazionale della Divisione di Chimica Organica della Società Chimica (Potenza, Italia). 31 Agosto-4 Settembre, 2004. (pp. P 46). (Comunicazione Poster).
3.
CAPUZZI M., GASPERI T., LORETO M. ANTONIETTA, TARDELLA P.A. . (2004). Synthesis and amination of alpha-(trimethylsilanylmethyl)ylidene-gamma-butyrolactones. 5th Spanish Italian Symposium on Organic Chemistry (Santiago de Compostela, Spain,). 10-13 Settembre 2004. (pp. PO-11). (Comunicazione Poster).
4.
DIETER ENDERS, TECLA GASPERI, LORETO M. ANTONIETTA, P.ANTONIO TARDELLA. (2004). Synthesis of Chiral-gamma-(Methoxycarbonyl)Allylsilanes. “Ischia Advanced School of Organic Chemistry IASOC 2004”. (vol. atti, pp. 70). (Comunicazione Poster).
5.
DOSZCZAK L., ENDERS D., GASPERI T., LORETO M. ANTONIETTA, SANT-DIZIER A. (2004). Sintesi di silil derivati isosteri di composti profumati. XXIX Convegno Nazionale della Divisione di Chimica Organica della Società Chimica (Potenza, Italia). 31 Agosto-4 Settembre, 2004. (pp. P47). (Comunicazione poster).
6.
GASPERI T., LORETO M. ANTONIETTA, TARDELLA P.A., ENDERS D. (2004). Alcossicarbonil Allilsilani per la sintesi di Ammino Esteri. XXIX Convegno Nazionale della Divisione di Chimica Organica della Società Chimica (Potenza, Italia). 31 Agosto-4 Settembre, 2004. (pp. O5). (Comunicazione orale).
7.
LORETO M. ANTONIETTA, MARCUCCI F., MIGLIORINI A., TARDELLA P.A. (2004). Sintesi di Spiroaziridine da alfa-metilen lattami. XXIX Convegno Nazionale della Divisione di Chimica Organica della Società Chimica (Potenza, Italia). 31 Agosto-4 Settembre, 2004. (pp. P 68). (Comunicazione Poster).
8.
LORETO M. ANTONIETTA, MIGLIORINI A., TARDELLA P.A. (2004). β-Amino ketones derivatives from alpha-(trimethylsilanylmethyl) alpha,beta-unsaturated ketones. 5th Spanish Italian Symposium on Organic Chemistry (Santiago de Compostela, Spain,. 10-13 Settembre 2004. (pp. PO-75). (Comunicazione Poster).
9.
LORETO M. ANTONIETTA, MIGLIORINI A., TARDELLA P.A. (2004). Synthesis and Amination of α(trimethylsilanylmethyl)α,β-unsaturated ketones. “Ischia Advanced School of Organic Chemistry IASOC 2004” Ischia Porto, Italy. 18-23 Settembre, 2004. (vol. Atti, pp 70). (Comunicazione Poster).
10.
GASPERI T., LORETO M. ANTONIETTA, MAZZETTI C., TARDELLA P.A., VECCHI E. (2003). Aziridinazione di Ammidi alfa,beta-insature-N,N-disostituite chirali. XXI Congresso Nazionale della Società Chimica Italiana (Torino, Italia). 22-27 Giugno 2003. (pp. OR-CP-069). (Comunicazione Poster).
11.
GASPERI T., LORETO M. ANTONIETTA, MIGLIORINI A., TARDELLA P.A. . (2003). Amminazione Stereoselettiva di alfa-iliden-gamma-alchil-gamma-butirrolattoni. XXI Congresso Nazionale della Società Chimica Italiana (Torino, Italia). 22-27 Giugno 2003. (pp. OR-CP-051). (Comunicazione Poster).
12.
FRANCAVILLA M., LORETO M. ANTONIETTA, TARDELLA P.A. (2002). Preparazione di derivati di beta-ammino fosfonati chiral. XXVIII Convegno Nazionale della Divisione di Chimica Organica, Roma. 16-20 Settembre, 2002. (vol. atti, pp. P144). Comunicazione Poster.
13.
GASPERI T., LORETO M. ANTONIETTA, TARDELLA P.A. (2002). Preparazione stereoselettiva di derivati di beta-ammino acidi beta,beta-disostituiti. 3. XXVIII Convegno Nazionale della Divisione di Chimica Organica , Roma,. 16-20 Settembre, 2002. (vol. Atti, pp. P197). (Comunicazione Poster).
14.
GASPERI T., LORETO M. ANTONIETTA, TARDELLA P.A., VERI E. (2002). Apertura regioselettiva di spiroaziridine preparate da alfa-alchilidenlattoni. XXVIII Convegno Nazionale della Divisione di Chimica Organica, Roma. 16-20 Settembre 2002. (vol. Atti, pp. P-145). (Comunicazione Poster).
15.
GASPERI T., LORETO M. ANTONIETTA, TARDELLA P.A. (2001). Amination of (1-trimethylsilanylmethyl-vinyl)carboxilic esters. 12th European Symposium on Organic Chemistry, ESOC 12 (Groningen, the Netherlands). 13-18 Luglio 2001. (vol. Atti, pp. P 2-209.). (Comunicazione Poster).
16.
LORETO M. ANTONIETTA, TARDELLA P.A., VERI E. (2001). Aziridinazione di alfa.alchiliden gamma-lattoni. XXVII Convegno Nazionale della Divisione di Chimica Organica, Trieste. 3-7 Settembre 2001. (vol. Atti, pp. P116). (Comunicazione Poster).
17.
BASSETTI M., D'ANNIBALE A., FANFONI F., MINISSI F. (2004). Sintesi dei lattoni del whisky e del cognac e loro analoghi attraverso metatesi dei sistemi diolefinici e riduzioni diastereoselettive. XXIX convegno nazionale della divisione di chimica organica della Societa' Chimica Italiana. 31/8/2005-4/9/2005. (vol. Atti, pp. P29).
18.
CAMPANELLA L., D'ANNIBALE A., FAVERO G., FERRI T., SANTUCCI R. (2003). MHBLM (Mixed Hybrid Bilayer Lipid Membrane) array per la Costruzione di Biosensori Recettoriali. XXI Congresso Nazionale della Società Chimica Italiana. 22-27 giugno 2003. (vol. Atti, pp. an33co). Torino.
19.
D'ANNIBALE A., FAVERO G., FERRI T. (2003). Characterisation of Ferrocene-tethered b-Cyclodextrin Surface for the Development of Innovative Biosensors. International Workshop on “Biosensors for Food Safety and Environmental Monitori. 9-11 ottobre 2003. (vol. Proceedings, pp. P-30). Marrakech (Marocco).
20.
FAVERO G., CAMPANELLA L., D'ANNIBALE A., MATTEI E., SANTUCCI R., FERRI T. (2003). Study of Mixed Hybrid Bilayer Lipid Membranes for Developing Receptor-based Biosensors. International Workshop on “Biosensors for Food Safety and Environmental Monitori. 9-11 ottobre 2003. (vol. Proceedings, pp. O-7). Marrakech (Marocco).
21.
D'ANNIBALE A., CASAMATTA F., CRISANTI C., FANFONI A. (2002). Ciclizzazioni 5-exo-trig di Esteri Allilici Promosse da Mn(III): Una Sintesi Radicalica del Lattone del Whisky e Suoi Analoghi. XXVIII Convegno Naionale della Divisione di Chimica Organica della SCI. 16-20 Settembre. (pp. P10).
22.
FAVERO G., CAMPAGNARO L., D'ANNIBALE A., FERRI T. (2002). Mediator-tethered Electrode based on Ferrocene-modified per-6-tio-b-cyclodextrin for the Development on Innovative Biosensors. EUROANALYSIS XII. 8÷13 settembre 2002. (vol. Proceedings, pp. 321). Dortmund (DE).
23.
D'ANNIBALE A., PETRUCCI CRISTINA, ROSSI FRANCESCA, TROGOLO CORRADO. (2001). LATTONIZZAZIONE DI ALCOOLI ALLILICI ED OMOALLILICI PROMOSSA DA Mn(III). XXVII Convegno Nazionale della Divisione di Chimica Organica. 3-7 Settembre 2001. (pp. P042). Trieste.
24.
D'ANNIBALE A., PETRUCCI CRISTINA, TROGOLO CORRADO. (2001). REAZIONI DI OSSIDRILAZIONE DI COMPOSTI LATTAMICI BETA-DICARBONILICI CATALIZZATA DA Mn(III). XXVII Convegno Nazionale della Divisione di Chimica Organica della Societa' Chim. 3-7 Settembre 2001. (vol. Atti, pp. P010). Trieste.
25.
FAVERO G., FERRI T., MUZZI M., DANNIBALE A., D'ANNIBALE A. (2001). Reconstituted Biomembranes: Stability Study and Detection of Inserted Ion-Channels. RSC - ELECTROANALYTICAL GROUP - New Directions in Electroanalysis. 22÷25 aprile 2001. (vol. proceedings, pp. P32). Salford (GB).
D) Altro (pubblicazioni non previste nei punti precedenti)
4. Richiesta di finanziamento del progetto
Note (specificare in dettaglio le spese)
4.1 A) Totale spese per l'acquisto di apparecchiature scientifiche
€
4.2 B) Spese generali per la ricerca
4.2.1 Materiali di consumo e manutenzione strumenti
(specificare il tipo di materiale e la strumentazione utilizzata)
€ 60.000
Reagenti chimici, solventi per cromatografia, gel di silice, lastrine per cromatografia su strato sottile, solventi anidri, colonne chirali, catalizzatori ed ausiliari chirali, gas compressi (Argon, Azoto ed Elio), azoto liquido, vetreria, estratti di pubblicazioni
4.2.2 Missioni - Seminari
€ 10.000
Partecipazione a congressi sia nazionali che internazionali
4.2.3 Raccolta, codifica e elaborazioni dati
€
4.2.4 Altre voci:
€
TOTALE A+B
70.000
4.3 C) Collaborazioni di ricerca (l'importo fisso è di 1.550 € lorde al mese, per un max di 12 mesi)
€ 18.600
Carboidrati, intermedi economici e da fonti rinnovabili, per sintesi ecocompatibili di prodotti biologicamente attive.
Tale ricerca presenta continui ed interessanti sviluppi, oltre ad una elevata competitività a livello internazionale
4.4 Ultimi tre anni di finanziamenti ottenuti sulla quota 60% di Ateneo
Anno
Fondo assegnato
Fondo non ancora utilizzato
4.4.1
Voce A 0
Voce B 0
Voce C 0
Anno
Fondo assegnato
Fondo non ancora utilizzato
4.4.2
Voce A 0
Voce B 0
Voce C 0
La dr.ssa Francesca Ceccacci, Laureata in Chimica, ha conseguito il dottorato di ricerca in Scienze Chimiche presso il Dipartimento di Chimica della “Sapienza”, svolgendo attività di ricerca scientifica nel campo della sintesi organica di prodotti biologicamente attivi. In base alla elevata qualificazione scientifica ed accademica, è stata ritenuta la persona altamente idonea come collaboratrice esterna al progetto di ateneo in corso.
CURRICULUM VITAE ET STUDIORUM DELLA DR. FRANCESCA CECCACCI
Francesca Ceccacci
Via Zucchelli 27, 00187 Roma
Tel. 0642723463 / 3392770720
francesca.ceccacci@uniroma1.it
Nata a Roma, 11/09/1973
Nazionalità Italiana
FORMAZIONE
2004 Collaborazione con il prof. Rinaldo Marini Bettolo nell’ambito del progetto “Studi per la sintesi di diterpeni policiclici bioattivi” presso l’Università di Roma “La Sapienza”.
2003 Assegno di ricerca CNR per lo studio del riconoscimento chirale in modelli di membrana.
2000-2003 Dottorato in Scienze Chimiche sull’argomento “Riconoscimento chirale in modelli di membrana”, sotto la supervisione della Dr. Giovanna Mancini e del Prof. Paolo Mencarelli, presso l’Università di Roma “La Sapienza”.
2000 Laurea in Chimica con lode, discutendo la tesi sperimentale “Ruolo dell’azoto chirale nella deracemizzazione di atropoisomeri in aggregati molecolari”, sotto la supervisione della Dr. Giovanna Mancini e della Dr. Antonella Dalla Cort, presso l’Università di Roma “La Sapienza”.
1992 Diploma di maturità con votazione finale 60/60 presso il Liceo Scientifico Statale “Farnesina” (Roma).
INCARICHI
2002 Borsa di collaborazione presso il Dipartimento di Chimica dell'Università di Roma “La Sapienza”, svolta nell'ambito del laboratorio didattico per i corsi dell’area organica (Chimica Organica I e II corso).
1996 Borsa di collaborazione presso il Dipartimento di Chimica dell'Università di Roma “La Sapienza”, svolta nell'ambito del laboratorio didattico per il corso di “Chimica Generale (I corso)”.
SCUOLE
“Corso Nazionale di Introduzione alla Fotochimica”, Dipartimento di Chimica “G. Ciamician” dell’Università di Bologna, 17 - 20 Settembre 2001.
XXVII Corso Estivo di Sintesi Organica “A. Corbella”, Gargnano (Brescia), 17 - 21 Giugno 2002.
“Scuola Nazionale di Chimica Bioinorganica per dottorandi”, S. Miniato (Pisa), 24 - 28 Giugno 2002.
“Corso di Introduzione alle Tecniche di Fluorescenza per dottorandi”, tenuto dal prof. Mariano Venanzi presso il Dipartimento di Chimica dell’Università di Roma “La Sapienza”, Maggio 2003.
“I Scuola Estiva Nazionale di Spettroscopie Chiroottiche”, Potenza, 28 Giugno -1 Luglio 2004.
PUBBLICAZIONI
P1) “Deracemization of an axially chiral biphenylic derivative as a tool for investigating chiral recognition in self-assemblies”, Stefano Borocci, Francesca Ceccacci, Luciano Galantini, Giovanna Mancini, Donato Monti, Anita Scipioni, Mariano Venanzi, Chirality (2003), 15(5), 441-447.
P2) “Construction and complexation studies of some self-assembled diporphyrin receptors”, Chiara Fanti, Donato Monti, Laura La Monica, Francesca Ceccacci, Giovanna Mancini, Roberto Paolesse, Journal of Porphyrins and Phthalocyanines (2003), 7(2), 112-119.
P3) “Determination of the rotational barrier of a chiral biphenyl: comparison of theoretical and experimental data”, Francesca Ceccacci, Giovanna Mancini, Paolo Mencarelli, Claudio Villani, Tetrahedron: Asymmetry (2003), 14(20), 3117-3122.
P4) “ Interaction of a chirally functionalised porphyrin derivative with chiral micellar aggregates”, Cecilia Bombelli, Veronica Cantonetti, Francesca Ceccacci, Giovanna Mancini, Donato Monti, Mariano Venanzi, Chemical Communications (2004), 972-973.
P5) “A new simple procedure for discriminating between deracemization and induced CD effect in chiral recognition experiments on atropoisomers”, Francesca Ceccacci, Marco Diociaiuti, Luciano Galantini, Giovanna Mancini, Paolo Mencarelli, Anita Scipioni, Claudio Villani, Organic Letters (2004), 6(10), 1565-1568.
P6) "Interaction of a Chirally Functionalised Porphyrin Derivative with Chiral Micellar Aggregates. Construction of a System with Stereoselective Cytochrome-P450 Biomimetic Activity", Cecilia Bombelli, Veronica Cantonetti, Francesca Ceccacci, Giovanna Mancini, Donato Monti, Mariano Venanzi,
Tetrahedron: Asymmetry (2003), 15(13), 1969-1977.
P7) "Elucidation of the Isomeric Domains Formed by Sodium N-Dodecanoyl-L-prolinate", Heintz Amenitsch, Cecilia Bombelli, Stefano Borocci, Francesca Ceccacci, Giovanna Mancini, Michael Rappolt, Journal of Colloid and Interface Science (2004), 280, 212-218.
COMUNICAZIONI A CONGRESSO
C1) “Deracemization of chiral biphenylic derivatives by chiral aggregates”, Francesca Ceccacci, Monica Fimiani, Giovanna Mancini, Anita Scipioni, “Fourth Cost -D11-Workshop on Supramolecular Chemistry”, Bled (Slovenia), 20-23 Settembre 2001.
C2) “Deracemization of chiral biphenylic derivatives by chiral aggregates”, Francesca Ceccacci, Monica Fimiani, Giovanna Mancini, Anita Scipioni, “5° Congresso Nazionale di Chimica Supramolecolare”, Frascati (RM), 30 September - 3 Ottobre 2001.
C3) “Effects of substituent position on chiral discrimination in micellar aggregates”, Stefano Borocci, Francesca Ceccacci, Monica Fimiani, Giovanna Mancini, “5° Congresso Nazionale di Chimica Supramolecolare”, Frascati (RM), 30 Settembre - 3 Ottobre 2001.
C4) “Deracemizzazione di derivati difenilici in aggregati micellari chirali”, Stefano Borocci, Francesca Ceccacci, Monica Fimiani, Giovanna Mancini, Anita Scipioni, “XXVIII Convegno Nazionale della Società Chimica Italiana – Divisione di Chimica Organica – 2002”, Roma, 16 - 20 Settembre 2002.
C5) “Chiral discrimination of dipeptides in biomembrane models”, Cristiano Bello, Cecilia Bombelli, Stefano Borocci, Francesca Ceccacci, Monica Fimiani, Giovanna Mancini, 1st Workshop of the COST Chemistry Action D27 “Origin of Life and Early Evolution”, Ravello, 17 - 20 Ottobre 2002.
C6) “Chiral recognition of atropoisomeric compounds in chiral aggregates”, Francesca Ceccacci, Marco Diociaiuti, Luciano Galantini, Giovanna Mancini, Anita Scipioni, Claudio Villani, “6° Congresso Nazionale di Chimica Supramolecolare”, Urbino, 7 - 10 Settembre 2003.
C7) “Recognition features of aggregates formed by a bola-amphiphile: a comparison with aggregates formed by conventional amphiphiles”, Francesca Ceccacci, Ilaria Gastaldi, Luciano Galantini, Giovanna Mancini, Fruehjahrssymposium 2004, Heidelberg, 31 Marzo – 3 Aprile 2004.
RELAZIONE ATTIVITA' SVOLTA
La Dr. Francesca Ceccacci ha svolto attività di ricerca nel campo della sintesi totale di terpeni policiclici bioattivi; in modo particolare la Dr.ssa Ceccacci si è occupata della sintesi dei dioli tetraciclici stemarin e orizalessina S.
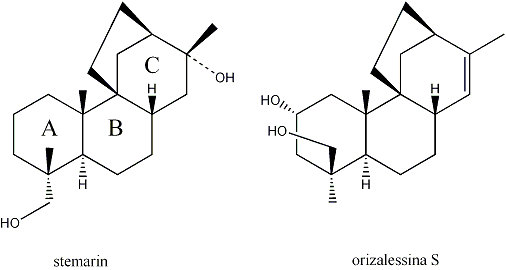
I risultati acquisiti hanno permesso di stabilire che l’intermedio chiave 9(11)podocarpen-12-onico, necessario alla sintesi di orizalessina S, può essere ottenuto secondo l’approccio BC ABC anziché B
ABC anziché B AB
AB ABC.
ABC.
La Dr.ssa Ceccacci ha potuto poi verificare che la tioacetalizzazione dei 6-idrossibiciclo[2.2.2]ottan-2-oni, condotta in condizioni di equilibrio, porta diasteroselettivamente al tioacetale eso. Ciò dovrebbe permettere di superare il problema relativo all’ottenimento diastereoselettivo dell’intermedio chiave biciclo[2.2.2]ottan-2-olico necessario per la costruzione, per trasposizione solvolitica, del sistema tetraciclico di stemarin e dell’ orizalessina S.
Anno
Fondo assegnato
Fondo non ancora utilizzato
4.4.3
Voce A 0
Voce B 0
Voce C 0
La dr.ssa Francesca Leonelli, Laureata in Chimica, ha conseguito il dottorato di ricerca in Scienze Chimiche presso il Dipartimento di Chimica della “Sapienza”, svolgendo attività di ricerca scientifica nel campo della sintesi organica di prodotti biologicamente attivi. Inoltre ha usufruito di un assegno di ricerca negli anni 2003-2004, svolgendo attività di ricerca nel settore delle strategie di sintesi di molecole comoùlesse. In base alla elevata qualificazione scientifica ed accademica, è stata ritenuta la persona altamente idonea come collaboratrice esterna al progetto di ateneo in corso.
CURRICULUM
Curriculum Vitae et Studiorum della Dr. Francesca Leonelli
Luogo e data di nascita: Roma 21/3/1974.
Studi e formazione:
. Maturità Scientifica conseguita presso il Liceo Scientifico Statale "L. Pasteur" nell'A.S. 1992/93.
• Laurea in Chimica presso l'Università degli Studi di Roma "La Sapienza" con voti 110/110 e lode il 19/2/1999 (A.A. 1997-98). La tesi è stata svolta presso il laboratorio del Prof. Rinaldo Marini Bettolo (Dipartimento di Chimica, Università degli Studi "La Sapienza") ed ha avuto per titolo: "Studi per l'ottenimento di sistemi biciclo[5.3.1]undecanici".
• Borsa di Studio della durata di sei mesi assegnata nel 1999 dalla Menarini Ricerche S.p.A. nell'ambito del programma di ricerche sul tema "Sintesi di intermedi e di molecole finali di interesse farmacologico" e svolta presso il Centro di studio per la Chimica delle Sostanze Organiche Naturali del CNR di Roma nell'Unità operativa diretta dal Prof. Rinaldo Marini Bettolo.
• Maggio 1999 Abilitazione alla Professione di Chimico.
• Vincitrice di una Borsa di Studio per il Dottorato di Ricerca in Scienze Chimiche XV ciclo presso l'Università degli Studi di Roma "La Sapienza" il 1/11/1999. La tesi, dal titolo "Diastereo and enantioselective syntheses of biologically active natural products: studies in the field of stemarane diterpenes" è stata svolta presso il Dipartimento di Chimica dell'Università degli Studi di Roma "La Sapienza" sotto la supervisione del Prof. Rinaldo Marini Bettolo. L'esame finale è stato sostenuto con esito positivo il 7/02/2003.
• Vincitrice di un Assegno di Ricerca biennale dell’Università degli Studi di Roma “La Sapienza” dal titolo "Sintesi di sostanze naturali bioattive", dal 1/01/2003 svolge la sua attività sotto la guida del Prof. Rinaldo Marini Bettolo e del Prof. Giovanni Piancatelli.
Partecipazione a Scuole:
• 23-28 settembre 2000 IASOC, Ischia (Napoli).
• 18-22 giugno 2001 XXVI Corso Estivo A. Corbella, Gargnano (Brescia).
• 21-26 settembre 2002 IASOC, Ischia (Napoli).
Partecipazione a Convegni:
• XXVII Convegno Nazionale della Divisione di Chimica Organica della Società Chimica Italiana, Trieste, 3-7 settembre 2001.
• 23rd IUPAC-2002 International Symposium on the Chemistry of Natural Products, Firenze, 28 luglio-2 agosto 2002.
• XXVIII Convegno Nazionale della Divisione di Chimica Organica della Società Chimica Italiana, Roma, 16-20 settembre 2002.
• Convegno Giovani Chimici, Dipartimento di Chimica, Roma, 15-16 giugno 2004.
• First-Austrian-German-Italian Meeting of Organic Chemistry, Vienna (Austria), 1-2 aprile 2005
Pubblicazioni:
1. Elusive 6-exo-Hydroxybicyclo[2.2.2]octan-2-ones from the Corresponding Acetates by Methanolysis in the Presence of CH3ONa/La(OTf)3, S. Di Stefano, F. Leonelli, B. Garofalo, L. Mandolini, R. Marini Bettolo, L. M. Migneco, Org. Lett., 4 (2002) 2783-2785.
2. The Formation of 8-Epipodocarp-9(11)en-12-one in the Course of the Preparation of Podocarp-9(11)-en-12-one from O-Methylpodocarpane and Related Studies, F. Leonelli, S. Borocci, L. M. Migneco, R. Marini Bettolo, Helv. Chim. Acta, 85 (2002) 2817-2826.
3. Chiral HPLC Resolution of the Wieland-Miescher Ketone and Derivatives, F. Leonelli, B. Garofalo, L. M. Migneco, R. Marini Bettolo, F. Colais, M. Sinibaldi, Journal of Liquid Chromatography and Related Technologies, 26 (2003) 409-424.
4. Hydrosoluble, Metabolically Fragile Bioconjugates By Coupling Tetrabutylammonium Hyaluronan With 2'-Paclitaxel-4-Bromobutyrate: Synthesis And Antitumor Properties, A-L. Capodilupo, V. Crescenzi, A. Francescangeli, R. Joudioux, F. Leonelli, R. Marini Bettolo, L. M. Migneco, M. Quagliariello, P. Bellato, G. De Luca, E. Galbiati, D. Renier, A. Banzato, A. Rosato, Hyaluronan 2003, (2003) in corso di stampa.
5. The intramolecular aldol condensation of 3-oxocyclohexaneacetaldehydes, L. M. Migneco, F. Leonelli, R. Marini Bettolo, ARKIVOC vii (2004) 253-265.
6. A New Preparation of 1,3,3-Trimethylbicyclo[2.2.2]octan-2,6-dione, a Never Isolated Key Intermediate in a Total Synthesis of (+)-Norpatchoulenol. A Formal Total Synthesis of (±)-Iso-Norpatchoulenol, A. La Bella, F. Leonelli, I. De Salve, L. M. Migneco, R. Marini Bettolo, Helv. Chim. Acta, 87 (2004) 2120-2124.
7. Neighboring-group Participation in Nitrile-forming Beckmann Fragmentation: Synthesis of Enantiopure (E)-2,3-di-O-substituted-5-methoxy-pent-4-enenitriles and Their Conversion into Pyranosylamines, P. Passacantilli, C. Centore, E. Ciliberti, G. Piancatelli, F. Leonelli, Eur. J. Org. Chem. (2004) 5083-5091.
8. A New and Simply Available Class of Hydrosoluble Bioconjugates by Coupling Paclitaxel to Hyaluronic Acid through a 4-Hydroxybutyric Acid Derived Linker, F. Leonelli, A. La Bella, A. Francescangeli, R. Joudioux, A.-L. Capodilupo, M. Quagliariello, L. M. Migneco, R. Marini Bettolo, V. Crescenzi, G. De Luca, D. Renier, Helv. Chim. Acta 88 (2005) 154-159.
9. Stereoselective Michael-Type Addition of Organocopper Reagents to Enones Derived from Glycals in the Synthesis of 2-Phosphono--C-Glycosides, F. Leonelli, M. Capuzzi, V. Calcagno, P. Passacantilli, G. Piancatelli, Eur. J. Org. Chem. (2005), accettato.
Relazione attività svolta
I carboidrati come precursori nella sintesi di prodotti biologicamente attivi
I C-glicosidi, analoghi degli O-glicosidi, in cui il legame glicosidico C-O è sostituito da un legame C-C, sono diventati negli ultimi anni dei target sintetici molto ambiti in quanto potenziali glicomimetici inerti agli enzimi e agli acidi. Grande è, quindi, l’interesse per lo sviluppo di nuove metodologie per la formazione del legame C-glicosidico, presente in numerose sostanze naturali dalle importanti proprietà farmacologiche.
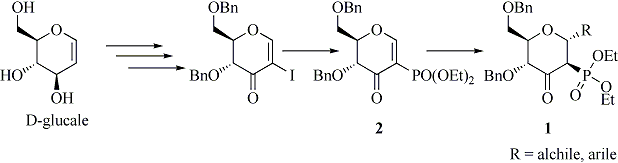
Nell’ambito del progetto di ricerca dal titolo “I carboidrati come precursori nella sintesi di prodotti biologicamente attivi” la Dr. Francesca Leonelli ha messo a punto una strategia sintetica per la preparazione diastereoselettiva di 3-osso-2-fosfono-a-C-glicosidi di tipo 1, composti mai sintetizzati in precedenza.
La strategia sintetica per la formazione diastereoselettiva del legame C-glicosidico ha avuto come punto cruciale la reazione di addizione coniugata secondo Michael di organocuprati su enoni derivati da glicali e contenenti il gruppo dietossifosfonato in posizione 2 (schema 1). La presenza del gruppo fosfonato nei composti tipo 2 è risultata determinante per la cinetica della reazione e inoltre potrebbe impartire ai composti in questione un’interessante attività biologica.
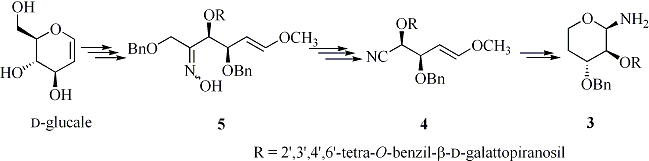
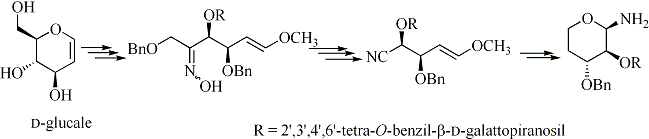
Inoltre la Dr. Leonelli ha collaborato ad uno studio sulla sintesi di piranosilammine di tipo 3 ottenute a partire da o-idrossinitrili di tipo 4 preparati per frammentazione di Beckmann di cheto-ossime di tipo 5 derivanti da carboidrati (Schema 2).
4.5 Consuntivo scientifico per l'ultimo anno di finanziamento ottenuto (risultati e pubblicazioni relative)
Consuntivo scientifico:
Nel campo della sintesi mediata da carboidrati, è stato svolto uno studio sulla formazione di nitrili per frammentazione selettiva di Beckmann di chetossime multifunzionalizzate. Da questo lavoro si è evidenziato che la frammentazione di Beckmann condotta su ossime chirali derivanti da (E)-6-metossi-1,3,4-tri-O-sostituiti-es-5-en-2-oni, ottenuti a loro volta da glicali e glicosilglicali, avviene stereospecificamente tra il C-1 e il C-2 ed è completamente diretta e controllata dall’ossigeno etereo adiacente al C-1. Non si riscontrano prodotti derivanti dalla rottura eterolitica tra il C-2 e il C-3 ed è quindi è esclusa l’assistenza alla reazione dell’eteroatomo al C-3. Per ciclizzazione riduttiva degli (E)-2,3-di-O-sostituiti-5-metossi-pent-4-enenitrili, ottenuti dalla frammentazione di Beckmann, sono state inoltre sintetizzate diverse piranosilammine (1).
Nel campo delle sintesi di lattoni, nel 2004 e’ stata perfezionata la metodologia di sintesi di composti butenolidici 4,5-dialchilsostutuiti 2 attraverso la ciclizzazione di metallil acrilati a struttura 1 via metatesi olefinica mediata da complessi del rutenio.
Tale metodologia e’ stata applicata con successo come stadio chiave alla sintesi di lattoni 4-metil-5-alchilsostituiti dotati di proprieta’ odorifere, in particolare il lattone del Whisky 3a ed il lattone del Cognac 3b, importanti composti presenti nei vini e nei liquori.
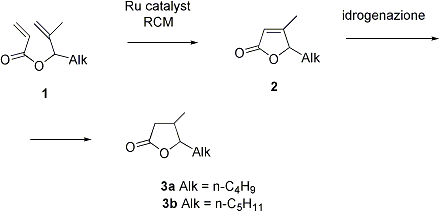
Tale via di sintesi ha portato all’ottenimento prevalente dei diastereomeri cis di 1a e 1b attraverso una idrogenazione non completamente diastereoselettiva dei corrispondenti butenolidi in condizioni di catalisi eterogenea (2).
Nell’ambito dell’interesse rivolto alle reazioni di amminazione di olefine elettronpovere ad opera del NsONHCO2Et in presenza di CaO, nell’ anno 2004 è stato intrapreso lo studio della stereoselettività del processo di aziridinazione su alfa-iliden gamma-butirrolattoni aventi un sostituente sull'anello.
In presenza di un gruppo alchile o fenile in posizione quattro, si è osservata la formazione di due aziridine diastereomere facilmente separabili. Inoltre con il fenile come sostituente si è avuta una buona selettività facciale. L’apertura dell’anello aziridinico ha confermato la possibilità di utilizzare questa strada per ottenere alfa-ammino lattoni otticamente attivi. E’ noto il crescente interesse sintetico per questi composti, precursori di alfa-ammino acidi non proteinogeni, versatili intermedi per la sintesi di composti biologicamente attivi.
Lo stesso interesse rivestono anche derivati di alfa ammino lattami; nell’ipotesi di ottenerli attraverso una strada analoga, sono stati sintetizzati alfa metilen gamma- e delta-lattami e i primi risultati indicano che in presenza di NsONHCO2Et e CaO si ottengono anche in questo caso, in buone rese, N-(etossicarbonil) spiroaziridine.
Sulla base della esperienza maturata sulla reattività di allilsilani variamente funzionalizzati è stato esteso lo studio della reazione di amminazione ad alfa.iliden gamma-lattoni sililati preparati attraverso una reazione di cross coupling catalizzata dal palladio.. La presenza del (trimetilsilanil)metile sul doppio legame, facilitando ed indirizzando l’apertura dell’aziridina intermedia, ha portato alla formazione di derivati di alfa-ammino lattoni insaturi.
I primi studi di amminazione condotti su beta cheto-allilsilani hanno confermato la facilità di apertura di aziridine di allilsilani infatti si sono ottenuti facilmente derivati di beta-ammino chetoni insaturi, questi composti vengono studiati per le loro attività in campo farmaceutico alcuni presentano infatti attività sia analgesica che antibatterica (3).
Per la sintesi di allilsilani funzionalizzati otticamente attivi, recentemente sono stati preparati aldeidi e chetoni alfa-sililati otticamente attivi L’analisi della loro struttura ha messo in evidenza una stretta corrispondenza tra lo scheletro di questi composti e quello di essenze note aventi proprietà organolettiche molto simili. In base alla teoria sulle relazioni tra struttura e profumo è stato possibile preparare una nuova serie di composti sililati caratterizzati da fragranze più o meno intense (4).
Pubblicazioni
1. PASSACANTILLI P.; CENTORE C.; CILIBERTI E.; PIANCATELLI G.; LEONELLI F. Neighboring-Group Participation in Nitrile-Forming Beckmann Fragmentation Reactions: Synthesis of Enantiopure (E)-2,3-Di-O-substituted-5-methoxy- pent-4-enenitriles and Their Conversion into Pyranosylamines EUROPEAN JOURNAL OF ORGANIC CHEMISTRY 2004 pp. 5083-5091;
2. BASSETTI M., D'ANNIBALE A., FANFONI A., MINISSI F. "Synthesis of a,b-unsaturated g-lactones via ring-closing metathesis catalyzed by first generation Grubbs' catalyst" ORGANIC LETTERS 2005, in press.
3. GASPERI T., LORETO M. A., MIGLIORINI A., TARDELLA P. A. Spiroaziridines from 4-substituted- alpha-ylidene-gamma-butyrolactones”.Heterocycles. 2005, 65(6) 0000.
4. DOSZCZAK L., GASPERI T., SAINT-DIZIER A., LORETO M. A., ENDERS D. Silylating reagents: A powerful tool for the construction of isosteric analogs of highly branched odorants. Chemistry & Biodiversity 2004, 1, 1921-1935.
5. Parere del Dipartimento/Istituto/Centro di appartenenza del responsabile
Data delibera:
28/04/2005
Parere:
POSITIVO
......................................